上一次我们讨论了微生物在癌变过程中的作用,今天,小编来和大家分享微生物与癌症治疗的知识。
尽管在理解肿瘤发生的分子机制和癌症的手术、放化疗多模式治疗方面取得了很大进展,但癌症仍然顽固难治。通过细菌、个体代谢、免疫反应和已知抗肿瘤药物间的相互作用如何调控癌症,是癌症治疗领域的一个新兴前沿。 细菌与治疗的整合形成了“药物微生物学”的精髓,微生物生物活性和与宿主的直接相互作用成为影响药物毒性和效力的重要因素。
发布时间:2018/09/11 浏览:101149次
上一次我们讨论了微生物在癌变过程中的作用,今天,小编来和大家分享微生物与癌症治疗的知识。
尽管在理解肿瘤发生的分子机制和癌症的手术、放化疗多模式治疗方面取得了很大进展,但癌症仍然顽固难治。通过细菌、个体代谢、免疫反应和已知抗肿瘤药物间的相互作用如何调控癌症,是癌症治疗领域的一个新兴前沿。 细菌与治疗的整合形成了“药物微生物学”的精髓,微生物生物活性和与宿主的直接相互作用成为影响药物毒性和效力的重要因素。

1、免疫治疗和微生物之间的相互作用
将T淋巴细胞靶向于共抑制或共刺激受体 - 配体系统,例如程序性死亡1(PD-1)编程的死亡配体1(PD-L1)和细胞毒性T淋巴细胞相关蛋白4(CTLA-4),已经成为征募宿主免疫系统对抗肿瘤细胞的治疗手段。随着认识到细菌和宿主免疫应答之间的相互作用,微生物对免疫治疗的影响也受到了科学界的关注。
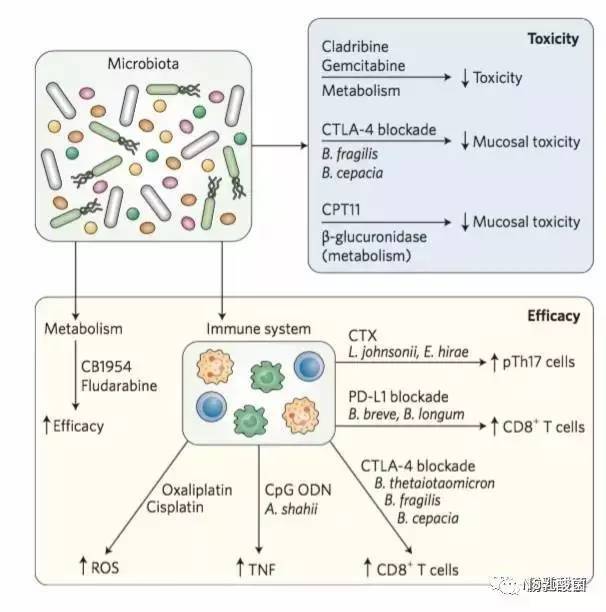
(1)微生物和免疫药物的毒性
抑制性抗体伊匹单抗,在治疗转移性黑色素瘤方面非常有效,但其对Treg细胞功能的抑制作用引起许多不良反应,比如肠道炎症。研究发现脆弱拟杆菌和洋葱伯克霍尔杆菌能改善抗生素治疗小鼠中CTLA阻断诱导的结肠炎症,这与对伊匹单抗源性的结肠炎抵抗的患者体内拟杆菌门菌高丰度的发现是一致的。
(2)微生物和免疫药物的效力
研究表明,细菌可以增强免疫系统检查点抑制剂的功效。在无菌或者给予广谱抗生素条件下,伊匹单抗(抗CTLA-4)治疗抑制MCA205肉瘤,MC38结肠癌和Ret黑素瘤的效果相对减弱。另外,摄入特异性菌株(多形拟杆菌,脆弱拟杆菌和洋葱伯克霍尔德氏菌)会刺激CTLA-4诱导的抗肿瘤免疫应答,增加治疗效果。转移性黑色素瘤的人体实验和相关动物实验支持了伊匹单抗治疗使免疫原性拟杆菌属细菌丰度增加,拟杆菌属菌增加又促进药物效力的假说。脆弱拟杆菌对树突状细胞的免疫刺激作用与之前脆弱拟杆菌免疫抑制作用的发现相矛盾,说明了宿主免疫系统与细菌相互作用的复杂性,免疫刺激或免疫抑制取决于细胞信号加工的复杂组合。
另一种免疫检测点阻断剂PD-L1的功效也依赖于细菌。小鼠的全基因转录谱和功能体外实验证明了短双歧杆菌和长双歧杆菌有利于PD-L1介导阻断皮下B16.SIY黑素瘤生长的抗肿瘤效应。双歧杆菌增强了树突状细胞的抗原呈递功能,导致CD8 + T细胞的抗肿瘤活性增强。值得注意的是,即使在没有PD-L1治疗的情况下,有双歧杆菌和长双歧杆菌定植的小鼠的黑素瘤生长受损,表明其直接参与了免疫抗肿瘤反应。
肠道菌群还能调节复合的抗IL10受体(抗IL10R)-抗体-CPG-ODN免疫治疗的抗肿瘤效果。类似于CTLA-4和PD-L1的皮下肿瘤模型研究证实了菌群缺乏对治疗效果的削弱,这种效应与宿主肿瘤坏死因子-α(TNFα)的产生和细胞毒性CD8 + T细胞的活化相关。将Alistipes shahii植入抗生素治疗小鼠,会导致抗IL10受体-抗体-CPG-ODN暴露后肿瘤相关骨髓细胞产生更多的TNF。
2、化疗与微生物之间的相互作用
化疗药物基本上诱导针对于快速分裂细胞的细胞毒作用, 其既可以针对癌细胞,但也可以针对骨髓和胃肠道(GI)等部位的特定正常细胞,通常导致免疫抑制和严重腹泻等不良反应。这限制了药物的使用剂量,降低了抗癌治疗的功效 。
(1)微生物和化疗的毒性
喜树碱-11(CPT-11)主要用于结直肠癌患者,其活性代谢物SN-38在肝脏中转化为无活性的衍生物SN-38G,这种衍生物通过胆管排泄到胃肠道中,在此,细菌的β-葡萄糖醛酸酶将其重新活化成细胞毒性的SN-38形式,从而引起肠上皮细胞的损伤并导致严重的腹泻。研究在小鼠中发现的大肠杆菌来源的β-葡糖醛酸糖苷酶抑制剂,可以缓解CPT-11诱导的消化道毒性。而这并没有改变伊立替康的药代动力学,表明药物毒性和效力可以通过靶向细菌的酶来解藕联。
与CPT-11类似,甲氨喋呤(MTX)也会引起胃肠道损伤。研究发现,抗生素介导的微生物消耗会增加小鼠中甲氨蝶呤诱导的粘膜损伤,这与TLR2信号传导有关。
(2)微生物和化疗的效力
环磷酰胺(CTX)会破坏小肠屏障功能,使肠细菌,特别是革兰氏阳性和对万古霉素敏感的约氏乳杆菌,鼠乳杆菌和希氏肠球菌易位至肠系膜淋巴结和脾脏。而细菌和免疫细胞之间的肠外相互作用对于诱导脾脏中表达干扰素-γ的致病性T辅助细胞17(pTH17)细胞至关重要,决定着药物治疗效果。 皮下肿瘤生长模型(P815肥大细胞瘤和MCA205肉瘤)中CTX的抗肿瘤作用在无菌、抗生素治疗或万古霉素(针对革兰氏阳性细菌)处理的小鼠中减弱,而摄入大肠杆菌和希氏肠球菌可以恢复抗生素治疗小鼠脾脏中的致病性TH17细胞反应。
奥沙利铂和顺铂都是广泛用于癌症治疗的烷化剂。如CTX所观察到的,使用广谱抗生素导致的菌群消耗降低了这些药物在皮下肿瘤生长模型(EL4淋巴瘤和MC38结肠癌)中的抗肿瘤功效,与骨髓细胞产生的活性氧相关。
微生物群拥有大量具有惊人代谢潜能的基因,不仅参与产能,而且能代谢许多外源物。 例如,在30种化疗药物与非致病性大肠杆菌Nissle 1917或李斯特氏菌血清型6B SLCC533410的预培养中,其中10种(例如吉西他滨,克拉屈滨,柔红霉素)显示出对Lewis肺癌细胞株的细胞毒性的减少,而6种化合物效力增加(例如,磷酸氟达拉滨,CB1954)。 细菌热灭活消除了对药物影响的差别,表明与这种现象有关的是酶活性而不是结构成分。 这些发现表明细菌可能直接代谢化疗药物并改变其疗效。
3、通过微生物治疗来调控癌症
微生物可以被用于癌症预防,检测、治疗和药物传递。通过菌群置换、益生菌和/或饮食来控制菌群可以促进使炎症和致癌活性最小化的菌群的生成,从而降低癌症风险。对细菌和宿主免疫反应的相互作用进一步了解证明,可以通过监测和管理微生物来调控患者对药物的代谢或与给定的抗癌药物“配合”以增强药效的同时降低毒性,从而个性化定制治疗方案。细菌还可以作为特异性治疗的传递者参与抗癌过程。细菌如沙门氏菌,大肠杆菌,梭菌和李斯特菌能在肿瘤组织中渗透和迁移,表明可以人工“武装化”这些细菌将一系列化合物递送入肿瘤组织,包括毒素和宿主信号分子(例如TRAIL(TNF-相关的凋亡诱导配体),Fas,细胞因子)、选择性激活肿瘤组织中前药的酶等。
总而言之,肠道微生物有在制定癌症精准治疗策略方面发挥重要作用的巨大潜能,但是将这一生态系统用于治疗非常具有挑战性。在这之前,需要更多基础和临床研究,使我们能够更好地了解宿主 - 环境相互作用的复杂性。
参考文献:
(1)Tsilimigras MC. Carcinogenesis and therapeutics: the microbiota perspective. Nature Microbiology. 2017 Feb 22;2:17008.
(2)Alexander JL, Wilson ID. Gut microbiota modulation of chemotherapy efficacy and toxicity. Nature Reviews Gastroenterology & Hepatology. 2017 Mar 8.
本文转自: 肠道科学
原题:专题:微生物与癌症(2)